腐蚀原理
-
-
腐蚀的形态可分为在常温下与水分和氧发生反应的湿蚀,以及在提炼或热轧加热过程中与氧反应的干蚀两种,平时较为常见的腐蚀现象为湿蚀作用下产生的腐蚀。
腐蚀原理
1. 湿蚀
湿蚀通过电化学反应进行,在水分和氧气存在的条件下,形成Anode(阳极,低电压部)和Cathod(阴极,高电压部),在两电极之间形成局部电池,加速金属的溶解氧化。通常不被氧化的金属结构组织较为均匀,但在加热,机械加工和各种附加因素作用下,结构会变得非常不均匀。这种不均匀的表面在存在水分和氧的条件下会在Anode(阳极,低电压部)和Cathod(阴极,高电压部)间形成腐蚀电流,造成腐蚀现象。
Anode : Fe → Fe2++2e-
铁原子被电力溶解,释放电子
Cathod : O2 + 2H2O + 4e- → 4OH-
在水分和氧作用下吸收电子形成离子
Anode生成物Fe2+与Cathod生成物OH-反应,或与水发生反应生锈。
Fe2++ 2OH- → Fe(OH)2
Fe2++ 2H2O → Fe(OH)2 +2H+
2Fe(OH)2 +¹₂O2 + H2O → 2Fe(OH)3
2Fe(OH)3 → Fe2 O3 + 3H2O
这里生成的Fe(OH)2, Fe(OH)3, Fe2O3是红锈的主要成分。
上述湿蚀在Anode(阳极, 低电压部)和Cathod(阴极,高电压部)形成局部电池,在氧气和水分存在的条件下产生腐蚀电流,这种局部电池的产生主要由不同金属的接触,氧气浓度的差异,液体温度的差异等导致。
① 不同金属的接触
即使是相同金属由于组织结构不均匀也会产生电位差形成局部电池。与钢材接触的金属比钢材电位高时(接触金属的离子化倾向较低时),钢材作为阳极被离子化溶解释放电子。
与钢材接触的金属比钢材电位低时(接触金属的离子化倾向较高时),钢材作为阳极被离子化溶解释放电子。举例来说,钢材与锌接触时,锌成为阳极被离子化,首先腐蚀。
(无机富锌底漆的作用原理) ② 氧的浓度差
在钢材表面氧浓度差作用下会形成局部电池。氧浓度较低的部位将成为阳极,氧浓度较高的部位将成为阴极,氧浓度较低的部位将被离子化释放电子。 ③ 液温的差异
接触钢材表面的溶液产生温度差会形成局部电池。 接触高温溶液的部位将成为阳极,接触低温溶液的部位将成为阴极,接触高温溶液的部位将被离子化释放电子。
综上所示,腐蚀是在水分和氧存在的条件下形成腐蚀电流,此时加速上述流程的因素还包括盐分(海盐)、硫化物、含氮化合物等。 因此金属腐蚀速度根据所处环境存在较大差异,通常环境条件下钢材的腐蚀速度如下所示。
受大气污染影响城市环境的腐蚀速度日益加剧,究其主要原因是废气中的主要成分NOx、SOx所致。NOx、SOx与大气中的水分相结合,生成弱酸性硫酸和硝酸,这是形成酸雨的主要原因,伴随大气污染的程度腐蚀速度将会加剧。 在工业区更是如此。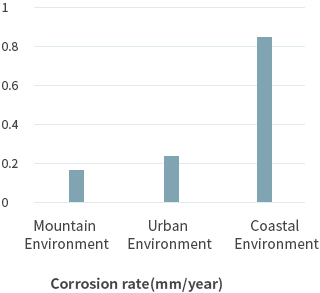
2. 干蚀
铸造钢材时,在热轧过程中,通过高温加热,钢材与氧发生反应被腐蚀的过程称为干蚀。 此时生成的铁锈较厚的黑皮氧化铁膜。
黑皮大多本身致密,结构组织稳定,成型时的冲击和长时间的反复冷热温差淬炼,极易导致龟裂和脱落。 出现龟裂和脱落后,钢材表面裸露,黑皮成为Cathod(阴极,高电位部),钢材成为Anode(阳极,低电位部),极易形成局部电池,腐蚀电流会加速钢材的腐蚀。 因此即使是结构稳定的黑皮也容易脱落,迅速生锈,请务必通过适当的表面处理清除后再涂抹防錆涂料。
特别是如果未事先充分清除黑皮就使用富锌底漆时,由于涂层不能与钢材表面直接接触,很难起到防腐蚀效果。
-